研究概要
2光子ホログラフィック顕微鏡による脳活動の可視化と光遺伝学刺激
(a)2光子ホログラフィック顕微鏡

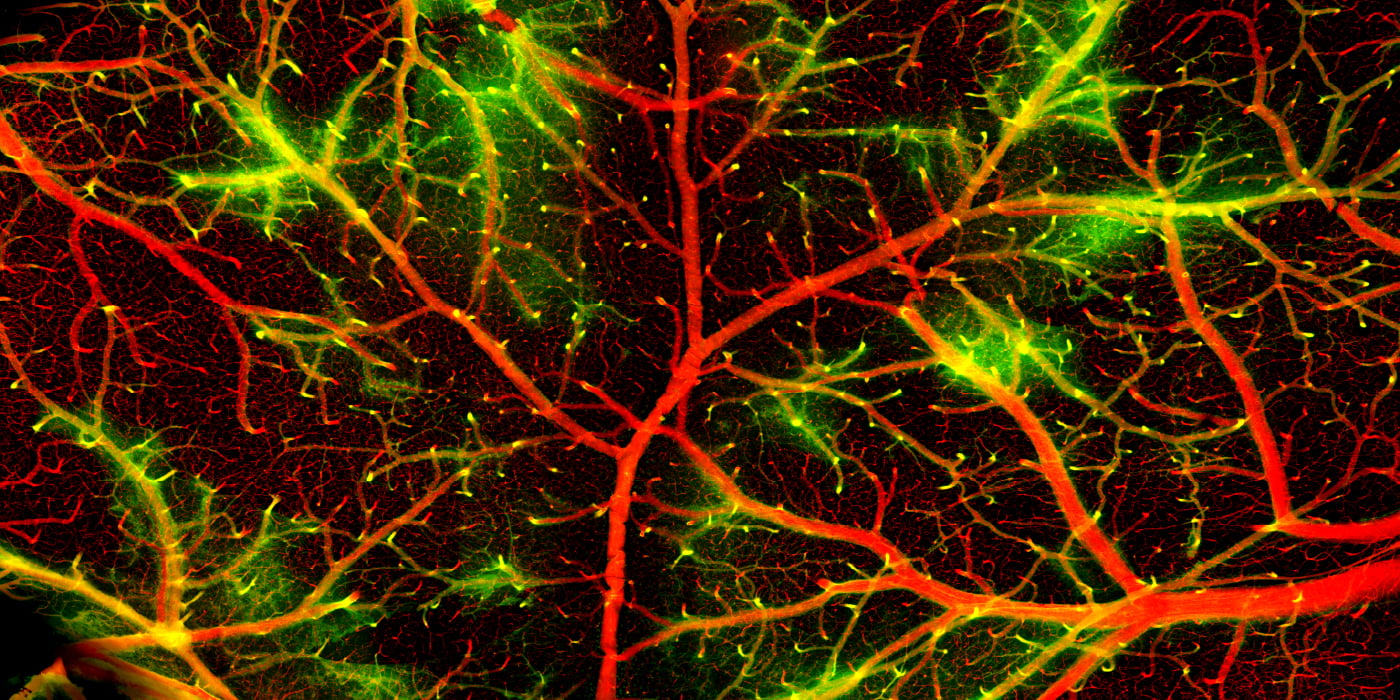
(b)大脳皮質の神経細胞と血流の2光子イメージング
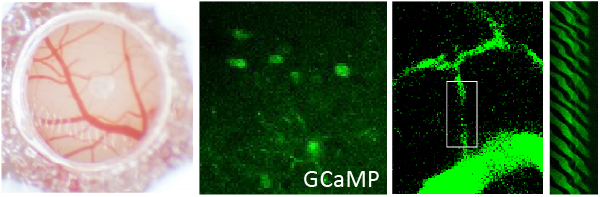
(c)ホログラフィック光遺伝学刺激よる神経活動の操作

脳は最後のフロンティアの一つです。脳における細胞活動が、ヒトの意識、感情、思考などを生み出すメカニズムは未だ解明されていません。これは脳における膨大な細胞活動を可視化・操作することが困難であるため、脳を理解するために十分なデータが得られていないためです。脳の内部を顕微鏡で可視化・操作することは簡単ではありません。細胞膜と水の屈折率が大きく異なるため、光が散乱し、画像が乱れるためです。この問題を解決するために開発された2光子顕微鏡は、散乱が起こりにくい近赤外光を用いることで、脳組織の表面から約1 mm 程度の深さまで蛍光イメージングを可能にしました。2光子ホログラフィック顕微鏡は神戸大学次世代光散乱イメージング科学研究センター(OaSIS)で開発された次世代の2光子顕微鏡であり (図a) 、脳内の神経活動や血流を蛍光イメージングするだけでなく(図b)、ホログラムと呼ばれる光の3次元のパターンを用いて細胞を光遺伝学刺激することができます (図c)。OaSISでは現在、巨大対物レンズと光デザインによる散乱補正を組み合わせることで、マウスの脳全体について細胞を可視化・操作することを目指した研究を行っています。私達の研究室は生物学の立場から、この研究に参画し、光学や情報科学の専門家とともに、「脳における細胞活動の可視化と操作」における限界を超えようとしています。また、顕微鏡開発を通じて始めて明らかにされた脳細胞活動から、脳の機能と病態を理解するための糸口を見出そうとしています。
アストロサイトの水チャネル(AQP4)を介した神経修飾因子放出の調節と精神疾患
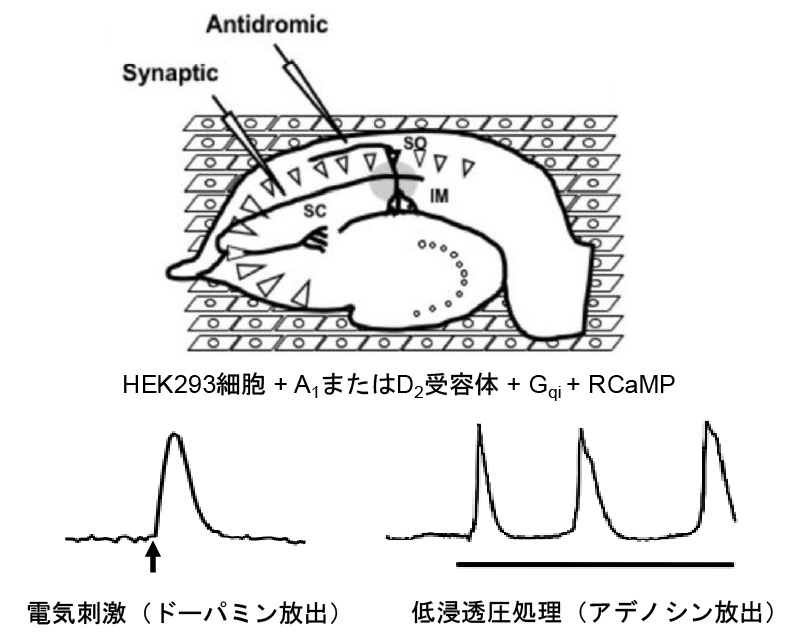
(a) 神経修飾因子の測定
(b) うつ様行動に関連したAQP4依存性アデノシン放出の増加とドーパミン神経伝達の不全
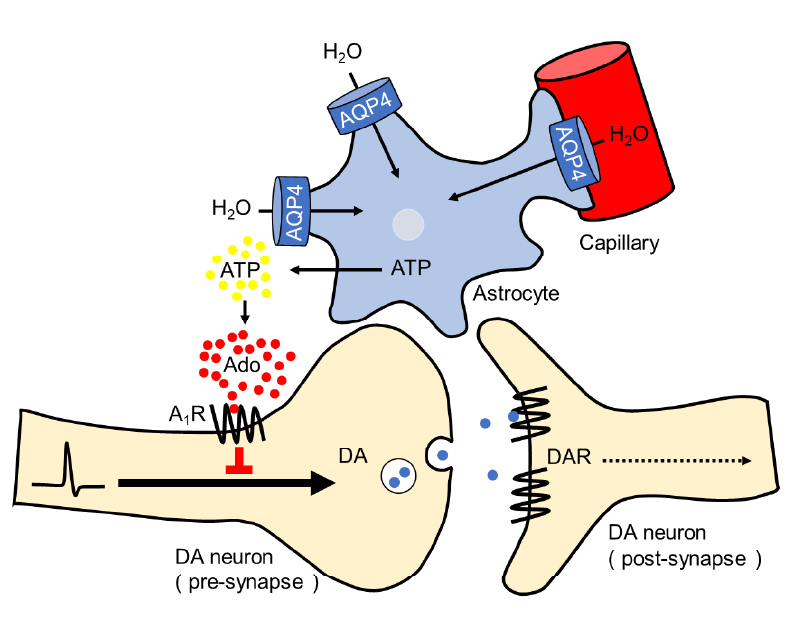
脳活動はアデノシン、ドーパミン、セロトニン、ノルアドレナリンなどの神経修飾因子によって調節されています。また、これら因子の増加や減少は、うつ病や分裂病といった精神疾患の原因である考えられています。特に、マウスのうつ様行動はヒトの「やる気」を理解するうえで重要なモデルです。私達の研究により、グリア細胞の一種であるアストロサイトの水チャネル(AQP4)が、アデノシンとドーパミンの量を調節しており、その異常がうつ様行動を引き起こすことが明らかになりました。具体的にはアデノシンまたはドーパミンに対して蛍光が上昇するセンサー細胞を遺伝子工学により作製し、この上に脳スライスを置き、電気刺激に伴うドーパミン放出や、低浸透圧処理に伴うアデノシン放出を測定しました(図a) 。覚醒剤の一種であるコカインは、禁断症状としてうつ病を発症するため、コカインを投与したマウスから脳スライスを作製し、測定に用いたところ、うつ様行動に伴い、AQP4を介したアデノシン放出が増加し、このアデノシンがドーパミン神経伝達を抑制することが分かりました (図b)。実際に、AQP4欠損マウスではコカインによるうつ様行動が見られません。現在は「コカインの投与が脳活動にどのような影響を与えるか?」「その影響はAQP4欠損マウスで変化するか?」などの点に着目し、2光子ホログラフィック顕微鏡を活用した研究を進めています。
脳傷害に伴うアストロサイトの活性化と創傷治癒
(a) 光傷害マウス
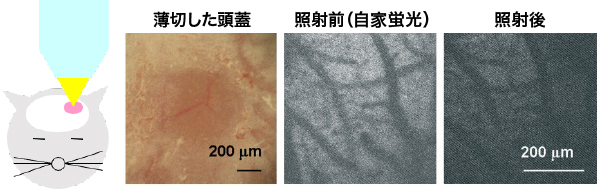
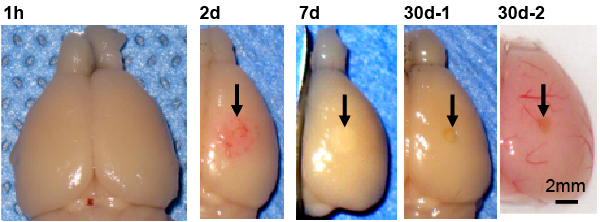
(b) 創傷治癒
(c) ネスチン陽性活性化アストロサイト

(d) ネスチン陽性活性化アストロサイトと創傷治癒
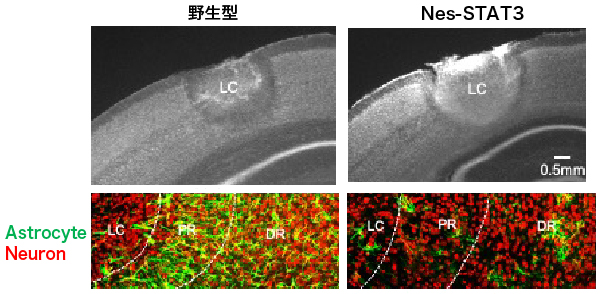
神経細胞やグリア細胞は、発生過程で神経幹細胞から産生されます。近年、神経幹細胞が、発生終了後のアダルトにおいても存在することが発見され、脳は再生する能力を持つと考えられるようになりました。私達は光傷害マウスという局所的に脳を破壊する方法を開発し、脳が再生するメカニズムを研究しています。光傷害は、薄切した頭蓋の一部から強い光を照射することで、脳の一部を破壊する方法であり(図a)、ニューメキシコ大学脳外科において、森田が開発しました。このモデルでは、光照射直後の脳組織に異常は見られませんが、1日後に出血がおこり、1ヶ月後には脳組織の一部が失われて脳挫傷が形成されます(図b)。この創傷治癒は交通事故やスポーツ事故で見られるヒトの頭部打撲とよく一致しています。また、光傷害マウスでは顕著な脳組織の再生が見られ、再生部位にはネスチンと呼ばれる神経幹細胞のマーカーを発現するアストロサイト(nestin-expressing reactive astrocyte, NRA)が集積します(図c)。さらに、NRA選択的にアストロサイト活性化に必要なSTAT3遺伝子を破壊すると、組織再生が進行せず、損傷が大きいままであるため(図d)、NRAは脳組織再生に不可欠な役割を果たしています。現在、私達は2光子ホログラフィック顕微鏡を活用し「ネスチン陽性活性化アストロサイトがどのように脳組織を再生するか?」「創傷治癒が脳活動にどのような影響を与えるか?」といった問題を研究しています。傷害により失われた脳の機能と神経回路が再構築される過程を明らかにすることで、感覚や運動といった脳機能がどのような神経回路によって担われているか、明らかになると期待されます。
局所的な傷害が引き起こす脳全体の水循環不全
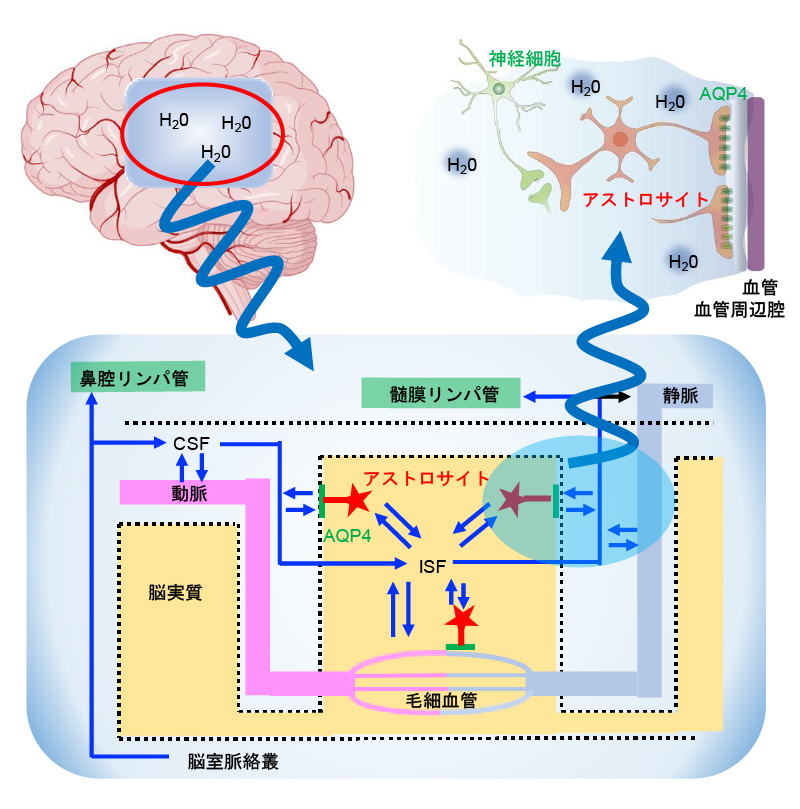
(a) 脳脊髄液(CSF)とAQP4
(b) 光傷害マウスにおける脳血流(CBF)と脳脊髄液の分布
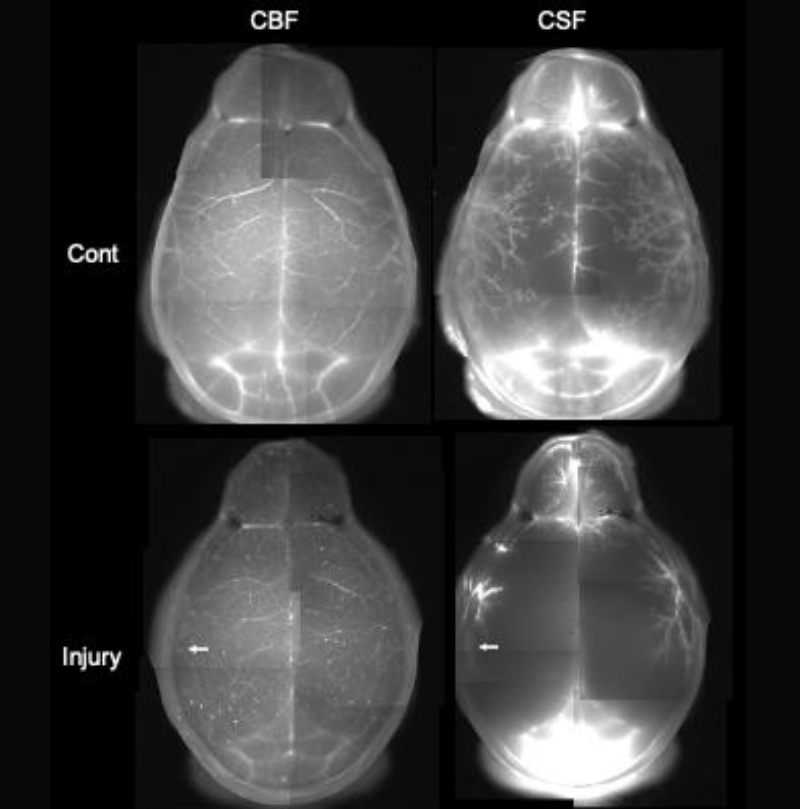
私達の体は血管系とリンパ系という2つの水循環を持っています。しかし、脳はリンパ系を持たず、その代わりに脳脊髄液(Cerebrospinal fluid, CSF)とアストロサイトの水チャネル(AQP4)という、独自の水循環を発達させています。CSFがどのように流れているかは、未だによく分かっていませんが、脳の血管は周囲にスペースを持ち、CSFはこのスペースを流れて脳組織内外を循環するという Glymphatic systemが提唱されています(図a)。また、AQP4はアストロサイトと血管の境界に高い密度で局在し、AQP4欠損マウスはGlymphatic systemの循環が著しく低下することが分かっています。このため、上述のAQP4依存的なアデノシン放出は、血管から脳内に水が流れ込む過程で活性化されると考えられます。私達は光傷害マウスのCSF循環を調べるため、脳血流(Cerebral blood flow, CBF)とCSFに異なる蛍光色素を注入し、二重標識しました(図b)。その結果、正常マウス(Cont)では脳表面の血管に沿って分布していたCSFが、矢印で示した部分に光傷害を作製したマウスでは、脳全体で減少していることが分かりました。おそらく脳は一部が壊れると、アストロサイトの活性化などによりAQP4を介した水流入が減少し、脳全体のCSF循環が悪化すると考えられます。この結果は、交通事故やスポーツ事故による頭部打撲が、脳を局所的に破壊すると、脳機能が全般的に低下したり、うつ病などの精神疾患を発症させることと関係しているかもしれません。私達は局所的な脳傷害が、 CSF循環と先述のAQP4依存的なアデノシン放出を脳全体で変調させ、脳機能に様々な影響を与える可能性を、2光子ホログラフィック顕微鏡を用いて検討しています。これにより脳の活動が水の循環により結び付けられている実態が明らかになれば、脳の機能と疾患を解明する新しい切り口になると期待されます。